图书馆VIP生命科学与医学部、合肥微尺度物质科学国家研究中心分子与细胞生物物理研究部赵忠教授课题组,近期揭示了植物干细胞抵御病毒侵染的分子机制。首次在植物广谱病毒抗性和分生组织维持机制之间建立了精确的分子联系,回答了为什么大部分植物病毒不能侵染顶端分生组织这一长期未决的生物学问题。相关成果以“WUSCHEL triggers innate antiviral immunity in plant stem cells”为题,于2020年10月9日发表于《Science》杂志。
植物干细胞是植物胚后发育所有组织和器官分化的源泉,具有自我更新和无限分化的潜能。在植物胚后发育中,除子叶、下胚轴和初生根之外所有的组织和器官均来自干细胞的分化。干细胞功能的稳定对植物的胚后发育至关重要,因此干细胞受到了植物体的严密保护,以避免其遭受外界生物或非生物的胁迫。
植物病毒病害是危害农业的第二大病害,严重影响了作物的产量和品质,甚至绝收。目前尚无有效的农药或化学制剂能够特异性地防治植物病毒,必要时只能将染病植株铲除,以防止病毒扩散。而茎尖脱毒技术是迄今唯一有效的、能够清除植物体内多种病毒的生物技术。该技术自上世纪50年代起,广泛应用于农业生产以获得脱毒苗,并在马铃薯、蔬菜、果树、草莓、花卉等作物中大面积推广。该技术适用作物范围广,能够清除多种病毒,具有广谱抗病毒的特点。这一技术应用的生物学基础是植物茎顶端分生组织病毒含量少,甚至没有病毒,其机制长期以来一直是未解之谜。
为了回答上述问题,赵忠教授课题组首先在拟南芥体内追踪定位了黄瓜花叶病毒(Cucumber Mosaic Virus, CMV)的分布模式。发现在茎顶端分生组织中CMV病毒恰好分布在干细胞重要调节子WUSCHEL(WUS)基因表达的下沿,不能感染植物干细胞所在中央区以及分化细胞所在的周边区和幼嫩花原基(图1)。进一步的发现表明,干细胞中WUS蛋白受病毒诱导积累,且异位移动到周边区,保护干细胞及其分化的子细胞不受病毒的侵染(图1)。
该研究证实如果在拟南芥叶片中异位表达WUS蛋白,可以保护整株植物不受CMV病毒的侵染。反之,在植物干细胞中可诱导的降解WUS蛋白,则导致CMV病毒侵染整个茎顶端分生组织。通过正反改变内源WUS的含量,研究人员证实了干细胞重要调控基因WUS在免疫病毒中的关键作用。
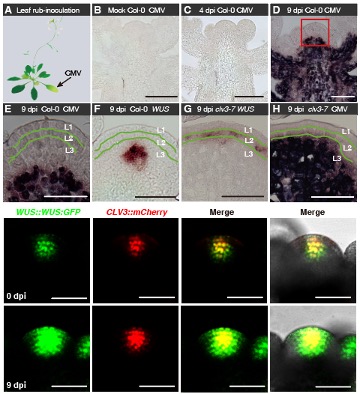
图1 植物病毒不能侵染WUS蛋白所在的干细胞区域及周边分化细胞
为了解析WUS介导的干细胞免疫病毒的分子机制,研究人员通过转录组学分析,鉴定了一类受WUS蛋白直接调控的下游基因:SAM甲基转移酶(S-adenosyl-L-methionine-dependent methyltransferases, MTases)。生化实验证明该甲基转移酶参与了25S核糖体RNA(25S rRNAs)的m5C甲基化。WUS直接抑制MTases基因的表达,影响了核糖体RNA的加工和核糖体的稳态,进而可以抑制病毒蛋白质的合成。
为了研究WUS介导的干细胞抗病毒免疫是否具有广谱性,该研究还检测了其他三种植物病毒:芜菁皱缩病毒(Turnip crinkle virus, TCV)、烟草脆裂病毒(tobacco rattle virus, TRV)和芜菁花叶病毒(turnip mosaic virus, TuMV),得到了一致的结论,说明WUS介导的抗病毒免疫可以针对多种植物病毒的侵染。由于WUS及其同源基因在植物中广泛存在,具有高度的功能保守性。这就进一步解释了为什么茎尖脱毒可以应用于多种不同种属的植物,并且能够清除感染这些植物的多种多样的病毒。
总之,该研究揭示了植物茎顶端分生组织存在广谱抗病毒免疫的分子机制。在侵染过程中,病毒必须利用植物细胞内的蛋白质合成系统合成自身的蛋白,以完成自身的复制、组装和侵染过程。而干细胞关键调节基因WUS则通过直接抑制细胞内蛋白质合成的速率,限制了病毒的复制和传播(图2)。该研究不仅回答了为什么植物病毒不能侵染植物分生组织这一长而未决的生物学问题,同时也为未来作物抗病毒防治提供了新的技术策略。
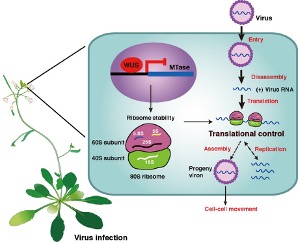
图2 图示说明WUS介导干细胞免疫病毒的分子机制
图书馆VIP赵忠教授和田朝霞副研究员为该论文的共同通讯作者,武海军副研究员为该论文的第一作者。广州大学董志诚教授和德国海德堡大学Jan U. Lohmann教授也参与了该研究。该研究得到了中科院B类先导、国家自然科学基金、科技部重大研究计划项目的资助。
完成单位:图书馆VIP,广州大学,德国海德堡大学,四川大学
(生命科学学院、科研部)
